上報 Up Media
toggle- 最新消息 木村拓哉新戲《Believe-為你架起的橋樑-》攜手天海祐希演夫妻 8位豪華卡司公開全網期待 2024-04-20 18:00
- 最新消息 台灣第一人!他勇奪美國變裝實境秀后冠 蔡英文祝賀 2024-04-20 17:40
- 最新消息 桃園新屋今又停電 張善政:這不是台電總經理能解決的問題 2024-04-20 17:03
- 最新消息 【明天播出】楊冪新劇《哈爾濱一九四四》搭檔秦昊 預告曝光她僅露臉8秒慘淪鑲邊女主 2024-04-20 17:00
- 最新消息 身體老化最怕這個問題?8 成熟齡族未老先花 温昇豪:新式老花雷射手術 CP 值超高 2024-04-20 17:00
- 最新消息 預測員工去向、留住新進人才 日本企業求助人工智慧 2024-04-20 16:50
- 最新消息 七旬婦裝2針孔偷拍房客 理由竟是「怕在屋內吸毒要蒐證」 2024-04-20 16:22
- 最新消息 《長月燼明》白鹿新劇搭檔《蓮花樓》曾舜晞爆不和 他「妝造醜翻」疑遭打壓粉絲氣炸 2024-04-20 16:00
- 最新消息 【廢死論辯】為死囚請命!王牌人權律師父子檔登庭對戰法務部悍將 2024-04-20 16:00
- 最新消息 柯建銘轟黃國昌助「藍」為虐 被問徐巧芯名牌衣秒回:對她沒興趣 2024-04-20 15:37
【斑馬魚模擬人體微環境】陽明大學培養出立體肺臟類組織 「遺傳性疾病」藥物有解

陽明大學27日舉行「立體3D肺臟類器官技術提破」記者會。左起陽明大學藥理所講座教授邱士華、生物藥學研究所教授何國牟、交通大學生物科技系教授張家靖、陽明大學藥理所教授黃自強。(蔣銀珊攝)
陽明大學發現1個特殊技術,從病患10 c.c.的血液,透過誘導性多功能幹細胞(iPS),在人體外成功培養出3D立體的肺臟類組織,這個肺臟類組織後續將移植到斑馬魚身上,解答囊腫性纖維化的病理機轉。
囊腫性纖維化是一種遺傳性疾病,是因為CFTR基因突變所造成。罹患這種疾病的患者,體內會產生異常濃稠的黏液,阻塞在身體多個器官中,例如汗腺、胰臟、膽管等。其中最常見的就是阻塞呼吸道導致呼吸衰竭。目前囊腫性纖維化病理機制不明,所以還沒有辦法有效治療。
為了探究囊腫性纖維化的致病機轉,陽明大學藥理所講座教授邱士華將會與陽明大學藥理所教授黃自強、生物藥學研究所教授何國牟以及交通大學生物科技學系教授張家靖共同合作。黃自強專精於囊腫性纖維化生理基礎研究及藥物開發,歷年來該實驗室描述了許多疾病突變的病生理機轉及藥物作用模式,在此計畫中黃自強將利用電生理及分子生物技術更進一步的了解造成此疾病的獨特突變背後的病生理機轉。

邱士華指出,研究發現1個特殊技術,可以經由血液培養出肺臟類組織,這樣的技術可以用在遺傳性疾病藥物上的研發;其中最重要的核心技術之一,是利用幹細胞重新編譯。
邱士華從病患體內抽取5到10 c.c.的血液,再利用諾貝爾醫學獎誘導性多功能幹細胞的技術,經由重新編譯回到胚胎時期,會極接近人體幹細胞,又叫胚胎幹細胞;而胚胎幹細胞經由重新編譯及基因改造技術,會具有分化成多功能的各種組織器官的潛力。
由於這個組織是來自病患血液,因此提供了研究攜帶CFTR基因突變的致病機轉的途徑。進一步將這個帶有基因突變的組織,移植到何國牟所飼養的斑馬魚身上,透過張家靖奈米技術將CRISPR/Cas9基因剪刀所編輯過的基因,送回斑馬魚身上和3D立體的肺臟類組織來嘗試修復缺陷的基因,觀察病理模型,並模擬活體中器官發育與生理狀況。

何國牟指出,斑馬魚跟人的基因體是非常相似,且班馬於是個非常好的宿主,利用異體移植將3D的肺臟類組織放入班馬於的體內,利用斑馬於創造跟人體相似的微環境,模擬人體環境,看到胚體發展後續。
邱士華指出,這此成功建立一個微環境(斑馬魚),可成功將IPS以及胚胎幹細胞分化成,具有3D立體結構的肺臟組織,經由這樣的分化平台,可以源源不絕的產生出很多小的肺臟組織類器官,有助於未來的基礎研究,特別對於遺傳性疾病的藥物篩選,是個非常大的助力平台,研究團隊希望能透過這種方式,建立起全新的臨床研究選項。

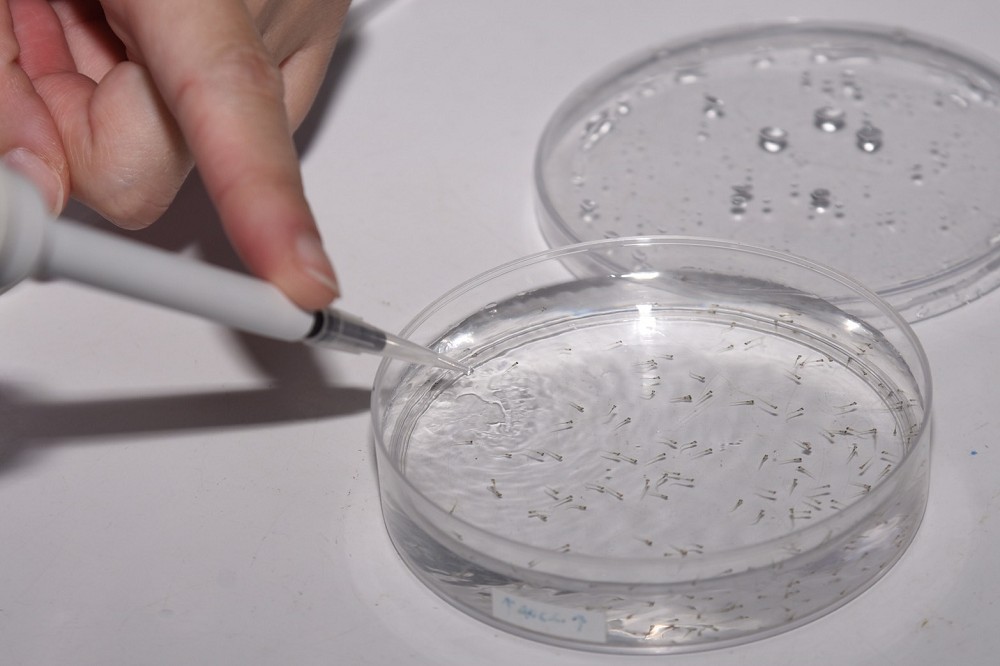

邱士華表示,這次研究是集中在囊腫性纖維化,臨床研究最大的困難就是不容易找病患,尤其是這種病患少的疾病;利用誘導性多功能幹細胞的技術加上基因編輯的治療平台,能運用在多種遺傳性疾病的藥物研發。除了囊腫性纖維化,研究團隊目前已應用在血液遺傳性疾病以及視網膜疾病上。
臨床研究需要建立的就是活體外與活體內的疾病模式,目前研究團隊已經在活體外重建人類組織以及3D肺臟類組織,下一步將要利用斑馬魚進行體內實驗。由於斑馬魚的全基因定序已經完成,非常適合從事先導實驗。
研究團隊期望這種創新的基因精準治療平台,能打造出安全且高效率的治療模式,提供臨床解決問題的新選項,加速精準基因療法研發,為罹患基因突變疾病患者帶來治癒的新契機,並期許能將此技術應用在新興感染症。(13印尼移工+1台男自美返台確診)
【熱門點閱】
●【中研院重大發現】大腦中蛋白質「TDP-43」 是加速阿茲海默症惡化關鍵









