上報 Up Media
toggle- 最新消息 不斷更新/【世棒四強賽】「中華隊 vs 美國」中華隊8局上未有建樹 暫以8:2領先 2024-11-22 14:10
- 最新消息 清華大學擬併中華大學 將設「清華平方科技園區」發展半導體 2024-11-22 13:51
- 最新消息 英王查爾斯三世加冕禮花費高達29.5億元 逾半民眾表態反對政府買單 2024-11-22 13:48
- 最新消息 【京華城弊案】朱亞虎200萬交保 李文宗11/26開延押庭 2024-11-22 13:30
- 最新消息 【世棒四強賽】峮峮也來了! 啦啦隊女神團美到登上東京巨蛋大螢幕 2024-11-22 13:10
- 最新消息 「巴西川普」波索納洛涉嫌政變 與4將軍企圖毒死或炸死正副總統 2024-11-22 12:50
- 最新消息 賴清德總統任內首次出訪選擇南太 黨政人士曝戰略考量 2024-11-22 12:40
- 最新消息 《大夢歸離》侯明昊錄真人秀在非洲草原拉屎 全程被外國遊客拍下秒登熱搜糗爆 2024-11-22 12:34
- 最新消息 【有片】露面了!謝宜容鞠躬道歉 落淚稱對不起家屬:孩子成冷冰冰遺體 2024-11-22 12:20
- 最新消息 美特使還在以色列進行調停 以軍持續對黎巴嫩空襲釀47死 2024-11-22 12:03
新冠肺炎治療藥物以《赫爾辛基宣言》為圭臬 「莫納皮拉韋」在台灣展開第三期試驗

在新冠肺炎的威脅下,美商默沙東藥廠研發口服的特效藥,正在全球及台灣展開第三期試驗。(取自美商默沙東藥廠官網)
全球新冠肺炎疫情爆發至今已超過一年半,對人體健康依舊有很大的威脅,光靠施打疫苗可能還不夠,若成功推出特效藥,將有望降低重症死亡率,並有效控制疫情。美商默沙東藥廠(MSD)研發的新冠肺炎口服抗病毒治療藥物「莫納皮拉韋」(Molnupiravir),目前於全球展開第3期臨床試驗,亞洲地區包含台灣、日本與菲律賓。
然而,部分民眾對於臨床試驗仍抱持誤解,擔憂被當成「白老鼠」。但大家可否想過,在這個連捐血都必須先告知對身體的風險、取得事前同意,也講求醫療個資安全與人權保障的時代,不太可能有人會因為參加臨床試驗,犧牲了自身的健康與權益,更別說臨床試驗是以科學為基礎。
實際上,臨床試驗也為病患帶來許多好處,如同醫師問診、檢查、診斷與治療等過程,甚至所開立的藥物,全都與臨床試驗有關。若沒有臨床試驗,新藥就無法上市,醫師也會缺乏客觀的評估標準,換言之,有臨床試驗的研究結果,再配合醫師的專業能力,才能提供病患最適當、最有效的治療,進而改善醫療品質與資源運用。
全球臨床試驗將《赫爾辛基宣言》奉為圭臬
隨著歷史演進,臨床試驗的制度也越來越嚴謹,訂定了很多相關的國際法規,確保參與臨床試驗的受試者安全、權益與福祉。在第二次世界大戰結束後,德國納粹與日本政府執行的非人道人體試驗陸續被揭發,讓醫學界開始發展相關的研究倫理規範,其中又以世界醫師會(WMA)在1964年提出的《赫爾辛基宣言》(Declaration of Helsinki)最為重要。
《赫爾辛基宣言》明訂臨床試驗的倫理規範,其精神約可分為自主(autonomy)、受利(beneficence)、公正(justice)等三大原則,都是以保障受試者的安全與權益為出發,此宣言也因應實務發展不斷討論與更新,提供更明確的道德指引。目前,全球所有的臨床試驗都必須符合《赫爾辛基宣言》,台灣自然也不例外。

台灣受試者保障與國際並駕齊驅
台灣推動臨床試驗制度已將近30年,也是亞洲最早參考美國食品藥物管理局(FDA)精神、建立符合國際醫藥法規協和會(ICH)法規環境的國家。無論是由藥廠或醫師提出臨床試驗,都必須向衛生福利部食品藥物管理署(TFDA)與醫院的研究倫理委員會(IRB)遞交計畫書,待審核正式通過後,才能開始進行臨床試驗。
研究倫理委員會的成員也不是誰都能擔任,按衛福部規定,必須由具醫學背景的專業人員與非醫學背景的社會公正人士共同組成,可以從不同專業面向與受試者觀點來審查計畫,是否符合倫理、法規與科學性。在臨床試驗計畫通過後,研究倫理委員會也會在執行期間進行監督,若在過程中發生違規,將有權要求修正、暫停或終止整個計畫。
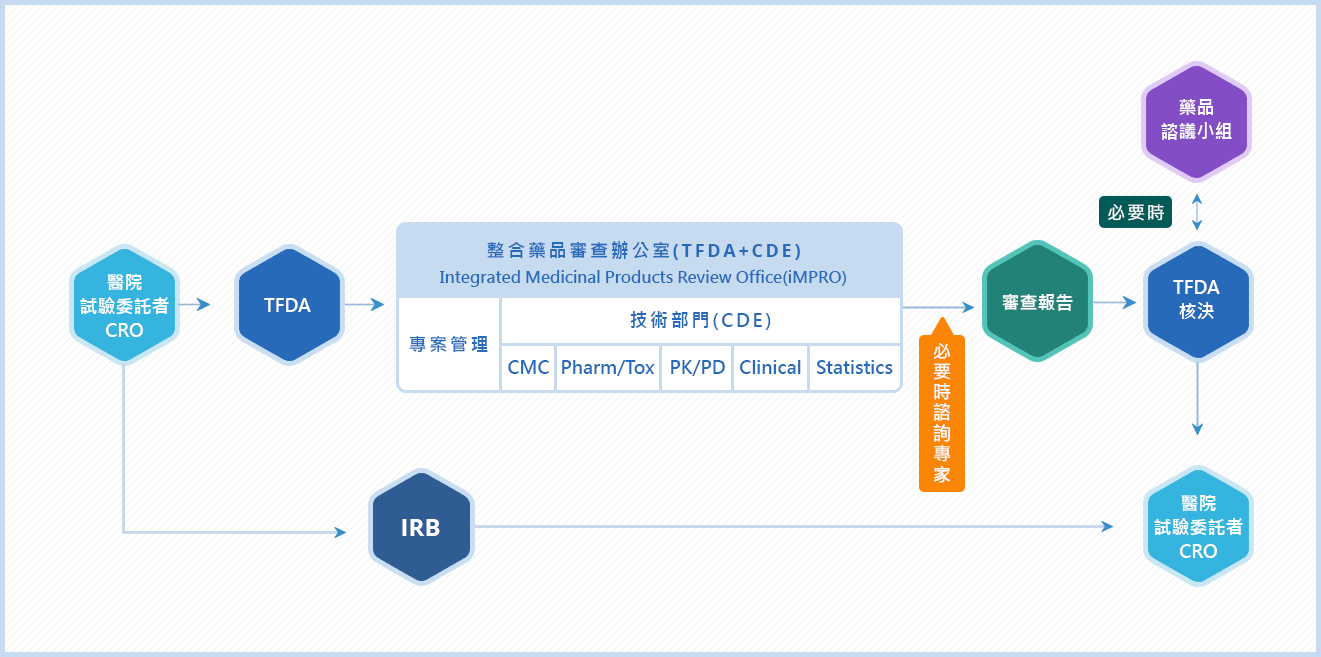
在受試者保障上,必須經過嚴格的審查流程,台灣亦與國際同步。例如臨床試驗受試者招募廣告必須事先經過各家醫院的研究倫理委員會審查核准,對用字遣詞有嚴格的規範,不能有任何權威背書,也不得於國中以下校園內刊登,甚至有些醫院的研究倫理委員會對招募廣告或海報張貼地點都有所規範。
臨床試驗主持人與醫院皆有義務告知病患參加臨床試驗可能面臨的好處與風險,經病患自行評估是否參與後,才能簽署知情同意書。只要受試者不想繼續,隨時都可以退出試驗,不需要提供理由,也不影響日後的醫療照顧。
近年來,臨床試驗更透過病人報告效果(Patient Reported Outcome, PRO),直接了解受試者對藥物或疫苗的反應程度,其測量結果不經過醫生或任何人的解釋與修正。病人報告效果大多採用填寫問卷的方式,讓受試者紀錄體溫、用藥紀錄與身體不適的狀況,如肌肉痠痛、頭痛或發燒等。
雙盲減少人為因素影響 讓試驗結果更可信
臨床試驗的規範之所以如此嚴格,正是因為攸關人體健康。無論是新藥或新的治療方法,在執行正式的臨床試驗之前,都得經過動物試驗階段,待有明確與充足的數據,證實對動物具有療效、不會有很嚴重的副作用後,才能開始臨床試驗,而藥物上市前的臨床試驗又分為三期。
第一期必須特別謹慎,僅在少數健康的受試者身上使用,主要是了解藥品的副作用、進入人體後的代謝程度;第二期則以病人為對象,受試者人數也不算太多,目的是為了確認新藥用在哪種適應症最為適合,以及該藥品最適當的劑量範圍;第三期是大規模的試驗,進一步蒐集藥品副作用與療效,讓試驗結果能夠應用到其他病人身上。
為了讓試驗結果更準確、具有可信度,第三期通常會採用雙盲試驗(Double-Blind Studies)的方式,受試者隨機分配為試驗組與對照組,試驗組將服用新藥,對照組則服用安慰劑或進行標準治療。在正式解盲(Unblind)之前,資料由第三方負責保管,受試者本身與研究人員都不知道誰是試驗組、誰是對照組,降低人為因素影響。
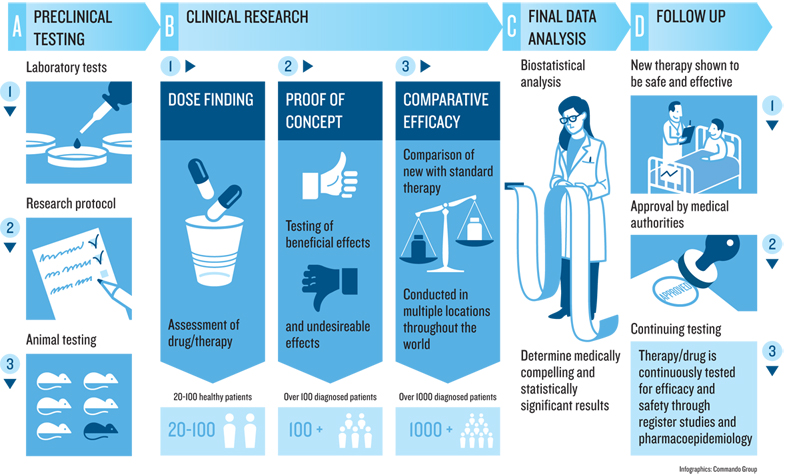
若受試者被隨機分配到對照組,是否會因無法立即使用新藥,而承擔較高的風險?基本上,受試者在同意參與之前,會被充分告知有此項風險,但即便是對照組,仍會接受標準治療,或是在疾病惡化時,採取已於計畫書中規範的緊急醫療處置,而且試驗過程會密切追蹤病情與治療狀況,甚至有機會得到更好的醫療照護。
對此,國際級腫瘤醫學專家、台大癌醫中心分院院長楊志新表示,在臨床試驗中,也規劃許多保障受試者的機制,若經資料安全監測委員會(DSMB)評估,新藥沒有突破性的進展,與現有藥物的治療效果差不多,試驗就會提早結束;或是新藥的成效非常好,也會提早結束試驗、收案,讓對照組盡快使用新藥治療,避免造成不公平。
臨床試驗已成為癌症病患的一線生機
原本專攻腫瘤內科的台大癌醫中心分院院長楊志新,觀察到當時的癌症治療方式,對病患沒有太大幫助,決定在1990年代赴美學習,返台後,協助衛生主管單位以及台大醫院建立執行臨床試驗的完善環境,希望讓更多病患能盡早使用新藥。從2000年起,他也致力投入標靶藥物與免疫療法的研究,並主導一系列跨國肺癌臨床試驗。
回顧台灣臨床試驗的發展歷程,楊志新感性說道,台灣發展臨床試驗將近30年,制度相當嚴謹仔細,從醫院端簽立合約、審查流程、執行期間、藥品如何保管都有清楚的規範與紀錄。台灣目前對於受試者的保障,有時還比國際標準還要嚴格。
楊志新也提到,在台灣臨床試驗制度化後,為癌症病患帶來更多好處,若病患沒有參與臨床試驗、使用最新研發的藥物,等待藥物上市需要3到5年時間,很可能等不到救命藥物,生命已到終點。20年前,國際就很清楚臨床試驗是癌症病人可以活比較久的途徑,因為能提早使用到研發中的藥物,很多國際級的癌症中心也都把臨床試驗當成第一要務。

「癌症病人多半對臨床試驗抱持很高的期待,希望有奇蹟性的治療效果。」楊志新說明,標靶治療的確為某些病患帶來快速的治療效果,讓病情控制得宜,還能維持好幾年,看起來幾乎康復了,但有些病患在一段時間後,身體就會產生抗藥性,也有部分病患接受治療後,卻沒有明顯成效。
臨床試驗不僅是病患的一線生機,更促使醫學進步。台大醫院臨床試驗中心主任陳建煒指出,一個治療或處置是否有效,需要經過臨床試驗的客觀判斷;臨床試驗除了作為醫療產品的核准基礎外,也推動了實證醫學(Evidence-based medicine, EBM)的發展,專科醫師群透過分析臨床試驗資料,制訂出治療的指引,並依據最新試驗結果隨時調整。
台灣臨床試驗軟實力堅強 盼未來再突破
關於台灣臨床試驗的競爭力,受實證醫學影響、曾在美國研究流行病學的陳建煒認為,台灣臨床試驗發展將近30年之久,有許多醫師前輩積極投入,付出相當大的努力,在肝癌、肺癌、胃潰瘍等疾病治療,都取得突破性的成果,不僅是在亞洲地區,也在國際居領導地位。
陳建煒也強調,台灣的研究團隊素質佳,人員受過良好的培訓,英文相對流利,病例以全英文書寫。臨床試驗制度更與國際同步,台灣在1998年成立財團法人醫藥品查驗中心(CDE),並邀請當時在美國食品藥物管理局任職的陳紹琛回台灣,協助強化臨床試驗醫事人員的專業能力。
值得一提的是,台灣從2008年開始參與國際醫藥法規協和會的活動,在2016年成為觀察員,隔年取得正式會員資格,代表台灣的醫藥法規已符合國際標準。在受試者保障的部分,也有亮眼的表現,到今年6月前,台灣有12家醫院通過全球最嚴格的美國臨床研究受試者保護評鑑(AAHRPP)。

面對台灣臨床試驗的未來,楊志新與陳建煒都抱持很深的期許,也有不少觀察與建言。陳建煒分享說,臨床試驗計畫書的審查目前要花3到4個月時間,希望在保障受試者權益的前提之下,盡可能再縮短時程;臨床試驗的經費與薪資結構也可以再提高,避免專業人才流失。
「我們的競爭對手,例如鄰近的中國、韓國與新加坡,在臨床試驗上投入大量人力,變得更有效率,反觀台灣在這方面的投資還不足夠。」楊志新表示,臨床試驗是比較奢侈的醫療行為,醫師花在受試者身上的時間,大概是普通病人的3到5倍,因此當一位醫師看太多病人,臨床試驗的專業度就會不夠。
楊志新也期盼能改善目前的行政流程,繼續增強台灣在臨床試驗的競爭力。他說,或許台灣的臨床試驗參與人數、行政效率,比不過中國與韓國,但研究品質相當好,台灣也是全球少數能執行第一期臨床試驗的國家,有能力招募受試者與蒐集相關數據。
※ 了解更多資訊,請上【CDE 台灣臨床試驗資訊平台】、【台灣藥物臨床研究協會】查詢
上報現在有其它社群囉,一起加入新聞不漏接!社群連結
熱門影音
熱門新聞
- 【懶人包】勞動部公務員疑遭職場霸凌輕生 事件始末「時間軸、手段、調查結果」一次看懂
- 起底謝宜容!傳身家背景雄厚「善做公關」 先生和綠營高層有交情
- 一元特典!YOASOBI「超現實」小巨蛋演唱會釋出「零星票券」,11/24 採實名制一般販售
- 【世界棒球12強賽】滿足「2條件」台灣確定晉級4強 今晚是關鍵
- 先搶先贏!Ado 五月林口體育館演唱會採實名制入場,11/19 輸入「指定代碼」可優先預購
- 【內幕】T112步槍裝彈器採購案疑專利侵權 以色列向軍備局寄存證信函
- 楊冪人氣暴跌與《慶餘年》張若昀演新片淪鑲邊女主 造型曝光全網夢回《三生三世十里桃花》
- 王一博金雞獎典禮被抓包視線離不開趙麗穎 網揭兩人4年戀情無法曝光背後真相











