上報 Up Media
toggle- 最新消息 江雅綺:外送員的保障在通過「外送員專法」 2024-11-23 07:00
- 最新消息 匹夫不可奪志 2024-11-23 07:00
- 最新消息 投書:速修考績法 杜絕公部門職場霸凌 2024-11-23 07:00
- 最新消息 香港形格勢禁犧牲者眾 台灣主權獨立猶有可為 2024-11-23 07:00
- 最新消息 許銘春否認是謝宜容靠山 嗆林淑芬「無憑據指控」不負責任 2024-11-23 00:07
- 最新消息 「包庇謝宜容失職又失格」 高雄青年聯盟要求許銘春退出市長選舉 2024-11-22 23:50
- 最新消息 深夜人事震撼彈!洪申翰接任勞動部長 王義川遞補不分區立委 2024-11-22 22:54
- 最新消息 把握周末好天氣 下周乾冷氣溫恐降至15度 2024-11-22 22:25
- 最新消息 衛福部3司長1組長被控霸凌 將於11/29公布調查結果 2024-11-22 22:07
- 最新消息 美國「新疆強迫勞動法案」最大行動 拜登將增29中企入黑名單 2024-11-22 22:02
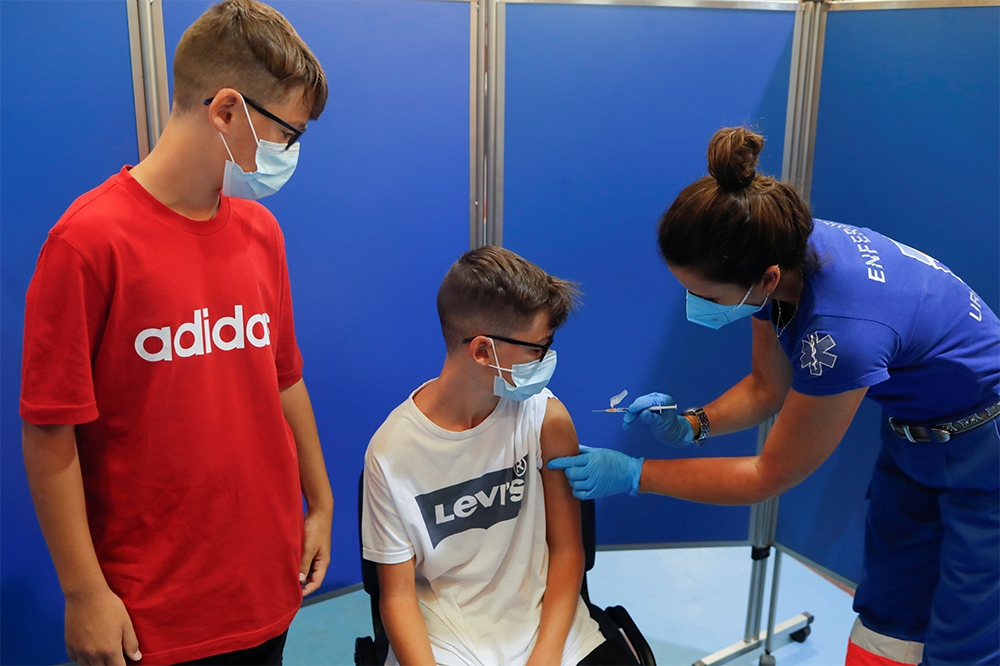
如果臨床數據可行,輝瑞將在9月底提出緊急使用申請。(湯森路透)
據美國衛生官員透露給《路透》的消息,政府預計在10月底讓5到11歲的兒童打BNT疫苗。開放日期仍取決於輝瑞/BioNTech公司,有臨床數據提供才能向美國食品藥物管理局(FDA)申請緊急使用授權。
消息之一源於美國免疫學家佛奇(Anthony Fauci)在國家衛生研究院(NIH)線上會議中,向數千名與會者提出的日程表。另一則消息來源也指出相似的日程表。
日程進度關鍵在臨床數據
數百萬名美國人引領期盼,尤其是家長們因為開學到來,擔心Delta變種病毒影響孩子的健康。目前期望FDA能在3周內完成疫苗對兒童的安全評估。
如果輝瑞在9月底提交緊急使用授權,而且它提供的數據也能佐證其功效,那麼就將如佛奇在會議中所言,「輝瑞可能將在10月的前幾周準備好」。
除了輝瑞,還有莫德納的也將提出授權使用,然而佛奇認為莫德納將花更長的時間去收集並分析5到11歲兒童的數據,估計開放該年齡層兒童接種莫德納的日程得等到11月。另外一則消息沒有明說,但卻表示「佛奇對莫德納的日程表有點太樂觀」。
關於這個會議的消息,輝瑞、莫德納與NIH沒有立即回應。不過輝瑞之前就曾表示,9月會準備好關於5到11歲兒童的數據,隨後申請緊急使用申請。莫德納則表示預計在年底完成對兒童施打的研究。
FDA通過程序期望縮減
申請不代表馬上就能開放,包括佛奇在內的衛生監管單位都表示,FDA的決定可能會遲至11月或更晚才做決定。

但據另一篇《路透》報導,測試兒童施打疫苗的臨床實驗必須經過至少兩個月的副作用觀察。FDA也表示,目前正在想辦法讓數據審核越快越好,希望能從幾個月縮減為幾周。
據FDA公布的疫苗研究到緊急使用授權路徑圖,疫苗製造商研製出的疫苗,臨床試驗前須先向FDA提出一次實驗申請,隨後才能進行3期臨床實驗。期間必須提交數據給FDA,FDA提供意見,再由製造商評估疫苗能否滿足FDA的預期,最後才會提出緊急使用申請。
製造商提出申請後,FDA將請專家評估該疫苗的各項數據,並召開諮詢委員會討論,確定疫苗的潛在利益大於風險,隨後通過緊急使用授權。
目前輝瑞已被授權用於12到15歲的美國兒童。另外2到5歲兒童的數據也即將準備好,6個月大到2歲嬰兒將在10月至11月取得安全性與免疫原始數據。
熱門影音
熱門新聞
- 【懶人包】勞動部公務員疑遭職場霸凌輕生 事件始末「時間軸、手段、調查結果」一次看懂
- 起底謝宜容!傳身家背景雄厚「善做公關」 先生和綠營高層有交情
- 一元特典!YOASOBI「超現實」小巨蛋演唱會釋出「零星票券」,11/24 採實名制一般販售
- 陳妍希與陳曉鬧婚變疑復合 她素顏與閨蜜聚餐模樣超清純全網夢回《那些年》
- 先搶先贏!Ado 五月林口體育館演唱會採實名制入場,11/19 輸入「指定代碼」可優先預購
- 【內幕】T112步槍裝彈器採購案疑專利侵權 以色列向軍備局寄存證信函
- 楊冪人氣暴跌與《慶餘年》張若昀演新片淪鑲邊女主 造型曝光全網夢回《三生三世十里桃花》
- 王一博金雞獎典禮被抓包視線離不開趙麗穎 網揭兩人4年戀情無法曝光背後真相










